Факторы и механизмы приобретенного иммунитета
05 Апреля 2020, Вс
Факторы и механизмы приобретенного иммунитета
 В процессе инфекции или после иммунизации изменяется реакция на антиген не только у иммунокомпетентных клеток и макрофагов. Как показали исследования И. Л. Кричевского и его сотрудники, клетки гладкой мускулатуры животных, иммунизированных бруцеллезным или брюшнотифозным эндотоксином, становятся невосприимчивыми к этим антигенам. Состояние ареактивности клеток гладкой мускулатуры специфично и сохраняется свыше 2 месяцев. Механизм этого феномена еще недостаточно изучен. Он не зависит от антител, поскольку пассивный перенос невосприимчивости другим животным не удается. По-видимому, этот феномен является следствием специфической иммунной перестройки клеток.
В процессе инфекции или после иммунизации изменяется реакция на антиген не только у иммунокомпетентных клеток и макрофагов. Как показали исследования И. Л. Кричевского и его сотрудники, клетки гладкой мускулатуры животных, иммунизированных бруцеллезным или брюшнотифозным эндотоксином, становятся невосприимчивыми к этим антигенам. Состояние ареактивности клеток гладкой мускулатуры специфично и сохраняется свыше 2 месяцев. Механизм этого феномена еще недостаточно изучен. Он не зависит от антител, поскольку пассивный перенос невосприимчивости другим животным не удается. По-видимому, этот феномен является следствием специфической иммунной перестройки клеток.Вопрос о специфической перестройке фагоцитирующих клеток в процессе иммунизации не получил еще однозначного ответа. Одни исследователи повышенную активность фагоцитов, полученных от иммунных животных, объясняли опсонизирующим действием антител, другие рассматривали этот феномен как следствие специфической перестройки самих фагоцитарных клеток.
Иммунные макрофаги содержат больше кислой гидролазы, переваривающая, дыхательная и митотическая активность у них выше по сравнению с макрофагами от нормальных животных.
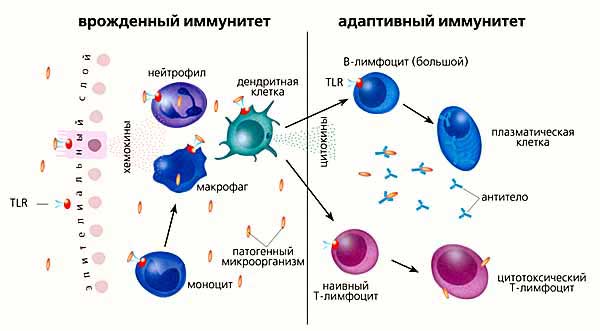
В отличие от неспецифических механизмов, обеспечивающих врожденную невосприимчивость, антитела являются фактором приобретенного специфического И. Они появляются в результате естественной инфекции или искусственной иммунизации. Специфическая иммунная реакция на бактерии, вирусы, токсины и другие чужеродные антигены осуществляется иммунокомпетентными клетками — Т, В лимфоцитами и макрофагами. Участие этих трех видов клеток в ответной иммунной реакции и их тесная функциональная связь не вызывают сомнений. Однако конкретные механизмы взаимоотношений между НИМИ в процессе формирования иммунитета остаются еще недостаточно изученными Взаимодействие антигена с Т-лимфоцитами, происходящими из вилочковой железы, ведет к их росту и делению, в результате чего увеличивается число специфически сенсибилизированных лимфоцитов. Для оптимальной продукции антител к большинству антигенов (Т-зависимых) требуется кооперативное взаимодействие между Т- и В-лимфоцитами. Встречаются, однако, антигены, состоящие из повторяющихся субъединиц, например, пневмококковый полисахарид, липополисахариды бактерий, полимеризованный флагеллин, поливинилпирролидон, которые могут стимулировать продукцию антител плазматическими клетками при отсутствии вспомогательной функции Т-клеток — так называемые Т-независимые антигены. Иммунный отпет на них ограничивается продукцией антител класса IgM, а формирования клеток иммунологической памяти на эти антигены не происходит. Однако, как показали исследования Брейли-Маллена (Н. Braley-Mullen, 1974), присоединение пневмококкового полисахарида к эритроцитам барана сообщало такому комплексному антигену свойство вызывать у мышей образование специфических к полисахариду антител класса IgG и формирование иммунологической памяти. Поливалентные антигены также могут взаимодействовать с В-клетками непосредственно, образуя множественные связи с находящимися на их поверхности рецепторами. Установлено, что функция иммунокомпетентных клеток детерминируется индивидуально доминантными генами иммунного ответа (иммунореактивными генами), тесно связанными с генами тканевой совместимости. Под действием иммунореактивных генов формируются клеточные и гуморальные иммунные реакции организма на любые чужеродные антигены.
Большим успехом в изучении иммунокомпетентных клеток явилось установление факта, что взаимодействие между клетками Т, В и макрофагами осуществляется молекулами специфических иммуноглобулинов, локализованными на поверхности клеточных мембран. Синтез этих иммуноглобулинов кодируется комплексом иммунореактивных генов. Согласно гипотезе Митчисона (N. Mitchison) и соавторы (1974), Т-лимфоциты при помощи специфических рецепторов (IgT) распознают антигенную структуру носителя (шлеппера), в отличие от В-лимфоцитов, которые, обладая другими рецепторами, распознают антигенные детерминанты полного антигена. Активированные антигеном (иммунизированные) Т-лимфоциты вырабатывают как специфические, так и неспецифические вещества, которые, освобождаясь с поверхности клеток, обеспечивают кооперативное взаимодействие макрофагов и В-лимфоцит».
Природа специфических факторов еще недостаточно изучена. По-видимому, они состоят из комплекса иммуноглобулина и антигена или антигенной детерминанты. Согласно гипотезе Фельдмана (М. Feldman) и соавторы (1974), этот комплекс (IgT- антиген) после взаимодействия с макрофагами, которые являются как бы своеобразным конденсатором антигенных детерминант, осуществляет запуск продукции антител В-лимфоцитами. Присоединение комплекса иммуноглобулина и антигенной детерминанты (специфического фактора) к поверхностным структурам макрофагов происходит т. о., что антигенные детерминанты остаются свободными и могут взаимодействовать с рецепторными структурами мембран В-лимфоцитов. Существуют и другие гипотезы кооперативного взаимодействия антигена с иммунокомпетбитными клетками.
Хим. природа и механизм действия неспецифического фактора также еще мало изучены. Предполагают [Адамс (Р. Adams), 1975), что он представляет собой или иммуноглобулиновый фрагмент, или небольшую небелковую молекулу, обладающую гормональным или адъювантным действием на В-лимфоциты.
Последние происходят из малых костномозговых лимфоцитов, на поверхности мембран которых в процессе созревания в селезенке и лимф, узлах формируются иммуноглобулиновые (lg) рецепторы — предшественники антител. Под действием антигенных детерминант В-лимфоциты пролиферируют, растут и превращаются в плазматические клетки, способные к активному синтезу и секреции антител.
Согласно клонально-селекционной теории Бернета (1971), каждому клону В-лимфоцитов присущ свой особый иммуноглобулиновый рецептор, способный взаимодействовать с определенной антигенной детерминантной. Наряду с короткоживущими плазматическими клетками, продуцирующими антитела, существуют долгоживущие В-лимфоциты, несущие функцию иммунологической памяти, благодаря которым осуществляется анамнестическая реакция. Взаимодействие клеток Т, В и макрофагов происходит в фолликулах центров размножения и в красной пульпе селезенки. Описанная П. Медаваром (1953) и М. Гашеком (1953) а реактивность организма к чужеродному антигену, наступающая в результате введения этого антигена в эмбриональном периоде, в отношении вирусов и бактерий окончательно не установлена. Было отмечено, что при врожденных вирусных инфекциях, вызванных, например, вирусами Гросса или лимфоцитарного хори менингита у мышей, свободные антитела к этим вирусам, но обнаруживаются или находятся в ничтожно малых количествах, что и давало основание трактовать этот феномен как состояние истинной иммунологической толерантности. Однако более тщательное научение показало, что н при этих врожденных инфекциях антитела образуются, но находятся они гл. обр. в связанном с вирусом состоянии и обнаруживаются в виде комплекса антиген — антитело на мембранах клеток почек и сосудов.
Иммунные реакции, как клеточные, так и гуморальные, могут быть искусственно подавлены повторным введением больших доз антигена, в результате чего наступает на некоторое время иммунологический паралич.
Продукция антител подчиняется общим закономерностям биосинтеза белков и происходит на рибосомах плазматических клеток. Кодирование синтеза специфических иммуноглобулинов осуществляется системой ДНК — РНК клетки, антиген же, по-видимому, осуществляет пусковую функцию, но не играет формирующей роли в образовании молекулы иммуноглобулина.
Специфические иммуноглобулины являются одним из важнейших факторов приобретенного гуморального иммунитета. Они нейтрализуют микробы и продукты их жизнедеятельности — токсины, ферменты, а также и другие чужеродные антигенные вещества животного и растительного происхождения. Значение иммуноглобулинов, среди которых различают 5 классов (IgM, IgG, IgA, IgD, IgE), в приобретенном И. неодинаково. Наибольшую роль играют IgG, IgA и IgM, в то время как защитная функция IgD и IgE сравнительно
невелика. Более того, с IgE связывают возникновение аллергии. IgG составляют около 70 — 80% нормальных человеческих иммуноглобулинов, a IgD и IgE находятся в сыворотки в относительно низкой концентрации.
Часть молекулы антитела, где локализован активный центр, косит название F ab-фрагмента. Способность активного центра молекулы иммуноглобулина реагировать только с определенной антигенной детерминантой зависит от его специфической трехмерной структуры, образованной небольшим числом аминокислот. В основе специфического взаимодействия лежит взаимная сферическая комплементарность активного центра антитела и детерминантной группы антигена. Антиген и антитело довольно прочно удерживаются вместе ван-дер-ваальсовыми и водородными силами межмолекулярного притяжения. Однако соединение антигена с антителом не необратимо. Нейтрализованный антителами токсин может быть полностью или частично восстановлен. Важную функцию выполняет также и другая часть молекулы иммуноглобулина, называемая Fc-фрагментом. Последний приобретает способность фиксировать комплемент (С1) после присоединения к молекуле антитела антигена. Следует иметь в виду и возможность независимой от антигена связи Fc-части молекулы IgG с компонентами клеточной стенки стафилококков (протеин А) и стрептококков [Стивенс, Рид (С. Stephens, W. Reed, 1974) с сотрудниками), а также присоединение реагентов (IgE) Fc- фрагментами их молекул к рецепторам базофилов и тучных клеток, что является начальной фазой в развитии аллергии.
Иммуноглобулины понижают степень дисперсности растворимых антигенов, вызывают их преципитацию, флоккуляцию, а у корпускулярных антигенов (вирусов, бактерий, спирохет, простейших) — агглютинацию и агломерацию. Фиксированные на мембранах спирохет, трипаносом и вибрионов комплексы иммуноглобулина и комплемента адсорбируют тромбоциты. Нагруженные т. о. микробы становятся менее подвижными, агломерируются, быстрее исчезают из крови, активно задерживаясь в лимфоидной ткани селезенки, лимф, узлов и других органов. Токсин, нейтрализованный антителами, утрачивает способность присоединяться к рецепторам чувствительных клеток. Укрупненный комплекс (токсин, антитоксин, комплемент) задерживается в барьерных органах и становится объектом фагоцитов. Аналогично действие антител и на вирусы. Специфически антитела, соединяясь с вирусами, блокируют их рецепторы, изменяют физизико - химические свойства поверхностных структур вириона, благодаря чему вирус не может адсорбироваться на незащищенной клетке и проникать в нее. Защитная функция антител в организме сводится к нейтрализации вирусов на их пути к чувствительной клетке, разобщению контактов между ними. (Витамины Виталайн)
Предохранить от возникновения вирусной инфекции может очень малое количество антител. Всего две или четыре молекулы антитела, предотвратить присоединение последнего к бактериям. При участии комплемента IgM и IgG могут лизировать бактерии, спирохеты, трипаносомы. Вопрос о возможности иммунного лизиса вирусов в течение долгого времени оставался открытым. М. А. Морозов и М. П. Королькова (1939) сообщили, что антитела могут вызывать лизис вируса оспы с полной потерей его инфекционных свойств. Через 30 лет появилось сообщение Альмейды и Уотерсом а (J. Almeida, A. WalORon, 1969) об иммунном лизисе вирусов инфекционного бронхита птиц и краснухи. У вируса инфекционного бронхита птиц, сенсибилизированного антителами и комплементом, под электронным микроскопом наблюдалось увеличение наружного ободка вириона и появление «вмятин» в наружной оболочке.
Ферментативное действие комплемента может иметь место только тогда, когда Ig присоединяется к оболочке, содержащей липопротеид.
Как показали исследования Орослана и Гилгика (S. Oroszlan, R. Gilgin, 1970), обработка вируса лейкоза мышей иммунной сывороткой и комплементом, приводила к освобождению из вируса группоспецифических антигенов, а вирус при этом становился чувствительным в РНК, что свидетельствовало о деструкции вирионов. Иммунная сыворотка и комплемент, взятые в отдельности, таких изменений не вызывали.
Характерные изменения у вируса опухолей кур в результате обработки его иммунной сывороткой и комплементом наблюдали Опуа и Вижье (М. Aupoix, Р. Vigier, 1975) под электронным микроскопом. Морфологические изменения предшествовали виролизису.
Комплемент потенцирует активность антител, ускоряет инактивацию вируса Хейнеман (Н. Heine- man). Активность ранних антител при первичной герпетической инфекции зависит от комплемента. Присоединение комплемента к Кс-части антитела, связанного с антигеном, создает дополнительные стерические помехи для вирусных рецепторов и тем повышает действие антител с низким титром, которые сами по себе могли только частично закрывать цитотропные рецепторы вируса.
Установлено опсонизирующее действие иммуноглобулинов в отношении всех без исключения антигенов, как растворимых, так и корпускулярных. Антитела способствуют процессу фагоцитоза и дезинтеграции чужеродных антигенов. Нейтрализованные антителами, они легче подвергаются перевариванию. Антитела оказывают более или менее губительное действие не только на бактерии, токсины и вирусы, но и на спирохеты, трипаносомы, плазмодии малярии, токсоплазмы. В эндемичных для малярии местах, например в Гамбии, дети рождаются относительно устойчивыми к малярии в течение первых месяцев жизни, по-видимому, благодаря передаче им от матери антител, нейтрализующих плазмодии малярии. Позднее, в возрасте от 1 года и до 5—8 лет, дети восприимчивы к заболеванию. Под влиянием иммуноглобулинов возникают новые антигенные варианты спирохет, трипаносом, устойчивых к первой генерации антител, что также свидетельствует о непосредственном действии иммуноглобулинов на эти микробы. По-видимому, антителам принадлежит главная роль в возникновении новых антигенных вариантов вирусов гриппа. В тех случаях, когда микроорганизмы (гонококки, бруцеллы, бактерии туберкулеза, лепры и, особенно, вирусы) локализуются внутри клеточно, антитела оказываются малоэффективными.
В функциях иммуноглобулинов различных классов имеются особенности. IgM (19S) появляются в результате первичной реакции организма и а введение антигена ранние антитела. Их удается обнаружить уже через 24-36 часов после внутривенного введения мышам вируса гриппа.
Определение антител класса IgM может быть использовано для ранней диагностики инфекции и установления, первично ли она возникла. Антитела этого класса принимают участие в нейтрализации патогенных микробов уже в самой ранней стадии инфекции. Они более активны в отношении крупных корпускулярных антигенов. Макроглобулины, полученные от кролика, в 750 раз более активны в реакции агглютинации эритроцитов человека группы А по сравнению с антителами класса IgG. Более активными были 198-антитела и в отношении холерных вибрионов и шигелл Флекснера. Антитела 19S в 100— 1000 раз более активны в реакции гемолиза при пересчете на одну молекулу, чем антитела класса 7S. Иммуноглобулины класса IgM более активно, чем все другие классы иммуноглобулинов, присоединяют комплемент. Комплемент активируется даже одной молекулой IgM, в то время как для получения аналогичного результата требуется не менее 20 молекул IgG. Антитела класса IgG, на долю которых выпадает важнейшая защитная функция, образуются позднее, чем антитела класса IgM, — на 2-й период после начала иммунизации. Около 70—80% иммуноглобулинов активных специфических сывороток принадлежит к классу IgG. Антитела этого класса изучены лучше, чем антитела других классов.
Антитела класса IgG особенно эффективны в нейтрализации мелкодисперсных антигенов: токсинов, вирусов. При повторной инфекции или иммунизации антитела IgG вырабатываются рано благодаря наличию клеток иммунологической памяти к соответствующим антигенам, что может служить показателем вторичного инфицирования. Молекулы IgG в силу своих небольших размеров могут проникать через плаценту от матери к плоду и обусловливать трансплацентарный иммунитет, сохраняющийся в течение нескольких месяцев после рождения. Авидитет антител, т. е. быстрота реакции их с антигеном и прочность образования с ним соединения, повышается в процессе иммунизации. Ранние антитоксические сыворотки обладают более низким авидитетом, чем поздние. Одна и та же сыворотка может содержать несколько популяций антител различной авидности.
Образование иммуноглобулинов того или другого класса зависит не только от продолжительности иммунизации, но и от свойств антигена, его дозы, способа введения, а также от вида и возраста животных.
Для нейтрализации антигенов и большей прочности связывания их детерминант имеет значение валентность антител. Бивалентные антитела более активны я авидитет их выше, они могут нейтрализовать вирусы или бактерии при более низкой концентрации, чем моновалентные. Бивалентные антитела, как показали Бланк, Лесли (S. Blank. G. Leslie) и соавторы, нейтрализуют вирусы в 1000— 2000 раз лучше, чем моновалентные. Однако прямой пропорциональности между увеличением валентности антител и усилением их нейтрализующей активности нет. Скорость диссоциации у комплекса моновалентные антитела — антиген выше, чем у комплекса того же антигена с бивалентными антителами. У бивалентных молекул антител энергия соединения с антигеном выше, чем объясняют меньшую их скорость диссоциации. Предполагают (Клинман, Лонг (Khnraan. С. Long) и соавторы, что бивалентные антитела возникли в процессе эволюции позднее, как дальнейшее совершенствование функции иммуноглобулинов, что способствовало повышению защиты организма от инфекционных агентов.
Комментарии
Пока нет комментариев
